乙4で出題される物理化学の分野についてポイントをまとめました。
ぜひ乙4試験の勉強(物理化学分野)にご活用ください。
- 乙4物理化学のポイントまとめ!要点や計算&過去問もチェック
- 乙4物理化学ポイント➀物理変化や蒸発&沸騰&沸点
- 乙4物理化学ポイント②指定数量の計算問題!
- 乙4物理化学ポイント③熱化学式の計算問題!
- 乙4物理化学ポイント④熱膨張(ボイル・シャルル)の計算問題!
- 乙4物理化学ポイント⑤比重の計算問題!
- 乙4物理化学ポイント⑥比熱の計算問題!
- 乙4物理化学ポイント⑦mol数の計算問題!
- 乙4物理化学ポイント⑧熱の移動
- 乙4物理化学ポイント⑨酸性とアルカリ性
- 乙4物理化学ポイント⑩イオン化傾向
- 乙4物理化学ポイント⑪自然発火とは?危険物の現象や物質
- 乙4物理化学ポイント⑫自然発火する動植物油類(第4類危険物)乾性油
- 乙4物理化学ポイント⑬自然発火する危険物(可燃性粉体の堆積物)
- 乙4物理化学ポイント⑭蒸発燃焼や表面燃焼の例&違いや爆発
- 乙4物理化学ポイント⑮原子や分子&化合物
- 乙4物理化学のポイントまとめ
乙4物理化学のポイントまとめ!要点や計算&過去問もチェック
乙4で出題される物理化学の分野をそれぞれみていきます。
乙4物理化学ポイント➀物理変化や蒸発&沸騰&沸点
| 物理変化 | 図解 |
| 固体から液体に変化することを【融解】 その逆は【凝固】 液体から気体に変化することを【蒸発(気化)】 その逆は【凝縮(液化)】 固体から気体、気体から固体に変化することをどちらも【昇華】 | 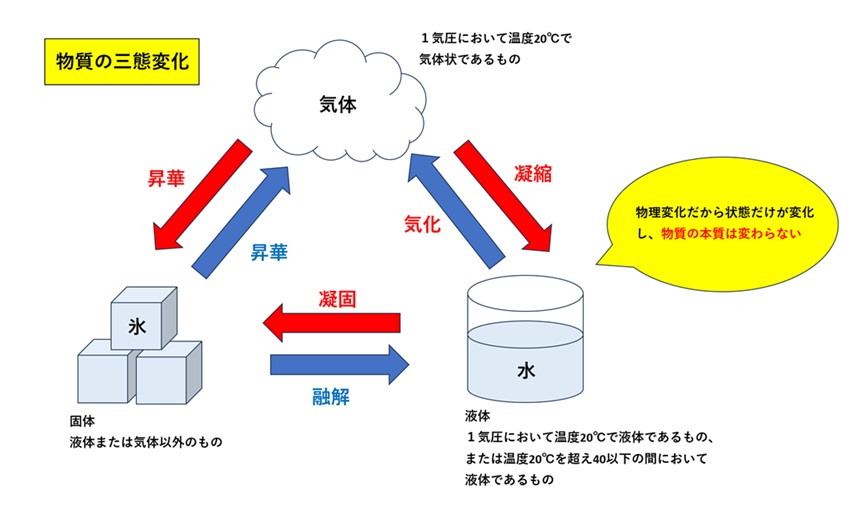 |
| 同じ温度で状態変化させるための熱を【潜熱】 物体の温度変化に必要な熱を【顕熱(けんねつ)】と呼ぶ | 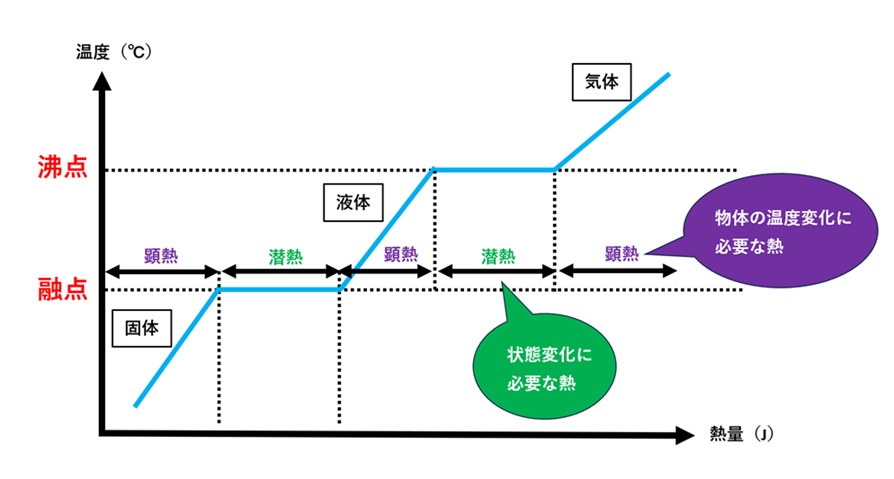 |
| 液体の表面から気化が起きることを【蒸発】 液体の中から気化が起こるのが【沸騰】 |  |
| 潮解 | 固体が空気中の水分を吸収して、自ら溶ける現象のこと |
| 風解 | 固体の水分が蒸発して粉末状になる現象 |
乙4物理化学ポイント②指定数量の計算問題!
指定数量は、危険物の品目ごとに定められた数量で、指定数量以上の危険物は貯蔵所以外の場所では貯蔵できず、製造所等以外の場所で取り扱うことはできません。
貯蔵や取扱い危険物の指定数量の倍数が1以上の場合は、消防法や危険物の規制に関する政令などの適用を受けます。
| 言葉の定義 | |
| 危険物の規則に関する政令 | 市町村の火災予防条例 |
| 以上 | 未満 |
| 以上、以下は、数値を含む 例:200以上⇒200を含む (200、201…) | を超える、未満は数値を含まない 例:200未満⇒200を含まない (199、198…) |
貯蔵・取扱い危険物が1種類の時の倍数は、
倍数=危険物の取扱数量÷危険物の指定数量
貯蔵・取扱い危険物が複数種類のときの倍数は、
倍数=(➀の取扱数量÷➀の指定数量)+(②の取扱数量÷②の指定数量)+(③の取扱数量÷③の指定数量)+(④の取扱数量÷④の指定数量)+…
となります。
また、指定数量が異なる2以上の危険物を貯蔵し、または取り扱う場合、指定数量の倍数を計算して、その倍数が1以上であれば、当該場所は指定数量以上を貯蔵、取り扱っているものとみなされます。
乙4物理化学ポイント③熱化学式の計算問題!
物質の温度が変化するとき、物質に蓄えられる、または放出される熱の大きさを熱量と言います。
そして発熱量=物体の質量×熱量で計算します。
| 熱量 | 物体を希望の温度に上げるのに必要な熱エネルギー量 単位はJ(ジュール)で水1gを1℃上昇させるのに必要な熱量は4.2J 熱量(J)=比熱(J/(g・K))×重さ(g)×温度差(K) 熱量が大きくなる条件(上記式参照) ➀比熱が大きい ②質量が大きい ③温度差が大きい |
| 熱容量 | ある物体の温度を1K(1℃)上げるのに必要な熱量 熱容量(C)=比熱(c)×質量(m) |
乙4物理化学ポイント④熱膨張(ボイル・シャルル)の計算問題!
物質の熱が移動することで起こる物理変化のひとつが熱膨張です。
そして物質の温度が1℃上がったときの物質の体積や長さの増加率を「膨張率」といいます。
第4類危険物の貯蔵において、容器の上部に十分な空間を残しておくのは、熱膨張による容器の破損を防ぐためです。
そして、気体の膨張は【ボイル・シャルルの法則】で表します。
【ボイル・シャルルの法則】
圧力×体積/絶対温度(K)=一定
PV/T=P’V’/T’(P=圧力、V=体積、T=温度)
絶対温度の0K=‐273℃、絶対温度の273K=0℃
また体膨張率や膨張分体積については以下の計算式で表します。
体膨張率=1℃上昇時の増加体積/元の体積
膨張分体積=元の体積×体膨張率×温度差
で計算できます。
例えば、ガソリンの体膨張率を0.00135(K⁻¹)として、ガソリン200Lが10℃温度上昇したとすると、
200(L)×0.00135×10℃=2.7(L)となり、
2.7L分が膨れてしまうという形になります。
乙4物理化学ポイント⑤比重の計算問題!
物質の質量を同じ体積の水の質量の何倍にあたるかを表した値が、水比重(単に比重ともいう)といいます。
比重=物質の重さ(g)/同体積の水の重さ(g)
また気体の質量が、同じ体積の空気の質量の何倍にあたるかを表す値が蒸気比重です。
蒸気比重=蒸気の重さ(g)/同体積の空気の重さ(g)
数値が1より大きい場合、それぞれ水または空気より重いことを示します。
- 標準の水の比重は1で、4℃のとき、比重が一番大きい
- 標準の空気における蒸気比重は1で、第4類の蒸気比重はすべて1以上で空気より重い
- 二酸化炭素は空気より重い
- 一酸化炭素は空位より軽い
乙4物理化学ポイント⑥比熱の計算問題!
物質の温度が変化するとき、物質に蓄えられる、または放出される熱の大きさを熱量と言います。
また物質の温まりやすさを表す数値が比熱です。
比熱が小さいものほど温まりやすく冷めやすいため、危険物では発火や消火のしやすさに大きく関わります。
| 比熱 | 物質1gの温度を1K(1℃)だけ上昇するのに必要な熱量 水の比熱は4.2 |
| 熱量 | 物体を希望の温度に上げるのに必要な熱エネルギー量 単位はJ(ジュール)で水1gを1℃上昇させるのに必要な熱量は4.2J 熱量(J)=比熱(J/(g・K))×重さ(g)×温度差(K) 熱量が大きくなる条件(上記式参照) ➀比熱が大きい ②質量が大きい ③温度差が大きい |
| 熱容量 | ある物体の温度を1K(1℃)上げるのに必要な熱量 熱容量(C)=比熱(c)×質量(m) |
乙4物理化学ポイント⑦mol数の計算問題!
molとは、原子や分子の数 が 【6.02 × 10²³ 】集まったものを 1molとし、物体それぞれでmol数が決まっています。
例)
H(水素)→1molあたり1g
O(酸素)→1molあたり16g
C(炭素)→1molあたり12g
乙4物理化学の計算例題については、また別記事でまとめていますのでぜひ挑戦してみてください。
乙4物理化学ポイント⑧熱の移動
熱の移動には、
伝導(熱が高温部から低温部へ伝わる現象)
対流(液体と気体に生じる)
放射【輻射】(熱が直接当たった面に伝わる現象)
の3つがあります。
熱エネルギーは、エネルギーの大きい(温度が高い)ほうから小さい(温度が低い)ほうに移動し、エネルギーが均等になれば温度は安定します。
また、物質の熱の伝わりやすさは【熱伝導率】という数値で表します。
電気を流しやすい物質ほど熱伝導率が大きく、熱が伝わりやすいです。
そして熱伝導率が小さいものほど熱がたまって燃えやすいといえます。
➀熱の移動には伝導(熱が高温部から低温部へ伝わる現象)、対流(液体と気体に生じる)、放射【輻射】(熱が直接当たった面に伝わる現象)がある。
②熱伝導率が小さいものほど熱をためやすく、燃えやすい
③電気を流しやすい物質ほど熱伝導率が大きく、熱が伝わりやすい
乙4物理化学ポイント⑨酸性とアルカリ性
酸性とは、物質が水に溶けて水素イオン(H⁺)を発生させている状態です。
反対にアルカリ性は、物質が水に溶けて水酸化イオン(OH⁺)を発生させている状態のこと。
物質を水に溶かしたとき、その水溶液が賛成なのかアルカリ性(塩基)なのかの度合いを表すのが水素イオン指数です。であり、PH(ピーエイチ、あるいはペーハーとも呼びます)
| (←強い)酸性(弱い→) | 中性 | (←弱い)アルカリ性(強い→) |
| リトマス紙(赤) | 無色 | リトマス紙(青) |
| PH 0、1、2、3、4 | PH(7) 5、6、7、8 | PH 9、10、11、12、13、14 |
酸は青色のリトマス紙を赤色にし、アルカリ性(塩基)は赤色のリトマス紙を青色にします。
乙4物理化学ポイント⑩イオン化傾向
イオン化傾向は、金属が陽イオンになろうとする性質で、一番イオンになりやすいにはカリウムです。
分子が相互に電子を受け渡し、電気的な性質をもつようになったものがイオンです。
他から電子をもらった分子は陰イオンに、電子を失った分子は陽イオンになります。
| イオン化傾向 |
| ←陽イオンになりやすい 陽イオンになりにくい→ |
| K、Ca、Na、Mg、Al、Zn、Fe、Ni、Sn、Pb、H、Cu、Hg、Ag、Pt、Au |
- K:カリウム
- Ca:カルシウム
- Na:ナトリウム
- Mg:マグネシウム
- Al:アルミニウム
- Zn:亜鉛
- Fe:鉄
- Ni:ニッケル
- Sn:スズ
- Pb:鉛
- H:水素
- Cu:銅
- Hg:水銀
- Ag:銀
- Pt:白金
- Au:金
金属は電子を失って陽イオンになりやすく、陽イオンになりやすい順に金属を並べたものがイオン化傾向です。
イオンになりやすい物質ほど化学反応しやすく、酸化しやすく、錆びやすくなります。
乙4物理化学ポイント⑪自然発火とは?危険物の現象や物質
自然発火は、点火源がない状態、 または可燃物が加熱されていない状態であっても、その熱が長時間蓄積されることで 物質が常温の空気中で自然に発熱し、燃焼を起こす現象です。
熱が発生する機構の種類は以下のとおり。
- 酸化による発熱
- 化学的な分解による発熱
- 発熱、発酵による発熱
- 吸着による発熱
そして発熱の機構ごとに発熱する物質をまとめました。
| ➀酸化による発熱 | 乾性油(アマニ油、キリ油等)、原綿、石炭、ゴム粉、鉄粉など ※カリウム、ナトリウムなどの第3類危険物は、リチウムを除き、ほとんどが空気中にあると酸化して自然発火する。 アルキルアルミニウムは発火性を有するため、-50℃以下でも空気と酸化反応を起こして自然発火する。 |
| ②分解による発熱 | セルロイド、ニトロセルロース(第5類危険物)など |
| ③発酵による発熱 | 堆肥、ゴミ、ほし草、ほし藁など |
| ④吸着による発熱 | 活性炭、木炭粉末(脱臭剤)など |
| ⑤その他の発熱 | エチレンがポリエチレンに重合する際の重合反応熱など |
乙4物理化学ポイント⑫自然発火する動植物油類(第4類危険物)乾性油
ポイントはこんな感じ(^^)/
- 動植物油類(第4類危険物)の自然発火は、油類が空気中で酸化され、その酸化熱が蓄積されることで発生する。
- 油類の酸化は乾きやすいものほど起こりやすい。乾性油は乾きやすく、空気中で徐々に酸化して固まる。
- 乾性油は、その分子内に不飽和結合 (C=C) を数多くもつ。この炭素間の二重結合に酸素原子が入り込むことで、酸化が起こり熱が発生する。
- ヨウ素価は、油脂 100g が吸収するヨウ素のグラム数で表され、不飽和結合がより多く存在する油脂ほどこの値が大きくなり、不飽和度が高い。ヨウ素価100以下を不乾性油、100~130を半乾性油、130以上を乾性油という。
- 乾性油の比重は水 (1) より小さく約0.9である。非水溶性で不飽和脂肪酸を含む。
乙4物理化学ポイント⑬自然発火する危険物(可燃性粉体の堆積物)
可燃性粉体の堆積物における自然発火について確認していきましょう。
粉体とは、固体 微粉子の集合体を指します。
可燃体の粉体として挙げられる例は以下のとおり。
- セルロース
- コルク
- 粉ミルク
- 砂糖
- エポキシ樹脂
- ポリエチレン
- ポリプロピレン
- 活性炭
- 木炭
- アルミニウム
- マグネシウム
- 鉄
これらの堆積物は、空気中の湿度が高く、かつ含水率が大きいものほど、 蓄熱が進み、自然発火に至ることが多い。 発熱と蓄積が進み、自然発火に至ることが多いです。
また、発熱と蓄熱が進む状況をまとめましたので確認してください。
【発熱と蓄熱が進む状況】
- 空気中の湿度が高く、気温が高いとき
- 気温が高く、堆積物内の温度が高いとき
- 物質の表面積が広く、酸素との接触面積が大きいとき
- 物質の熱伝導率が小さく、保温効果が高いとき
乙4物理化学ポイント⑭蒸発燃焼や表面燃焼の例&違いや爆発
燃焼とは、【物質が酸化するとき、発光と発熱を伴うもの(定義)】
燃焼には、蒸発燃焼、分解燃焼、表面燃焼、内部燃焼の4種類があります。
とくに第4類危険物の引火性液体の燃え方は「蒸発燃焼」なので覚えておきましょう。
概要や例をまとめるとこんな感じ(*’▽’)
| 概要 | 例 | |
| 蒸発燃焼 | 可燃性液体の液面から蒸発する可燃性蒸気が空気と混合して燃えること。第4類はすべてこの燃焼である。 | アルコール、ガソリン |
| 分解燃焼 | 熱分解して発生する可燃性ガスが先に燃焼するもの。 | 木材、石炭、プラスチック |
| 表面燃焼 | 固体のまま固体の表面で燃焼するもの | 木炭、コークス |
| 内部(自己)燃焼 | 酸素を含んでいる物質が含有する酸素で燃焼すること | セルロイド、ニトロセルロース |
また常温で物質が熱を蓄積して、燃焼に至るのが自然発火です。
第4類危険物である動植物油類の乾性油は酸化しやすいので、布に染み込んだまま空気中に放置すると表面が酸化してその酸化熱で自然発火してしまいます。
セルロイドやニトロセルロースなどは、物質がもつ酸素で自ら分解し、その分解熱で発火するので注意しましょう。
一方で、酸化には、さびる、燃える、爆発する(瞬間)、の3種類あり、違いは【反応する早さ】の違いです。
具体的には、酸化の中でも非常に速い速度で酸化が起こったときに、発火を伴っているのが燃焼であるともいえます。
燃焼が、酸化反応のひとつと考えると良いでしょう。
乙4物理化学ポイント⑮原子や分子&化合物
物質の分類
| 物質 | 純物質 | 単体 |
| 化合物 | ||
| 混合物 | ||
- 分子には1種類の原子だけで構成される単体と、2種類以上の原子で構成される化合物があり、1種類の単体分子だけ、あるいは1種類の化合分子だけでなる物質を純物質と呼ぶ
- 炭素原子(C)を含む化合物を有機化合物と呼ぶ
- 化学変化には酸化、燃焼、化合、分解、重合、還元、中和などがある
| 用語 | 概要 |
| 化合(化学合成) | 種類の異なる単体分子が化学反応を起こして結合し、新しい物質(化合物)になること 例)酸素と水素が化合すると水になる |
| 分解(化学分解) | 1つの化合物が2種類以上の物質になること 水を電気分解すると酸素分子と水素分子に分解できる |
| 重合 | 単純な構造の分子化合物(モノマー)が複数結合して大きな化合物(ポリマー)になること |
| 中和 | 酸(酸性)と塩基(アルカリ性)が化学反応して、お互いの性質を打ち消すこと。2種類の化合物がお互いの成分を交換して、新しい化合物を生じる複分解反応の一種 例)塩酸と水酸化ナトリウム水溶液を混ぜると、塩(塩化ナトリウム)となり、元の塩酸の酸性と水酸化ナトリウムのアルカリ性の性質がなくなる。 |
乙4物理化学のポイントまとめ
それぞれの乙4物理化学ポイントを確認して過去問に挑戦してみよう!
計算方法をしっかりチェック!
以上です。
ありがとうございました。

.jpg)
.jpg)
コメント